單堿基編輯技術以其高效和精確的基因編輯能力,成為目前最有希望治愈各種遺傳疾病的明星工具。但由于Cas9蛋白本身存在的Cas9依賴性脫靶一直無法解決,人們依然對其臨床應用的安全性表示擔憂。近日,五邑大學生物科技與大健康學院張焜教授、廣東省醫學大動物模型重點實驗室賴良學研究員和鄒慶劍副教授團隊合作,以五邑大學為第一單位在MolecularTherapy(IF:11.45)在線發表了題為“Eliminating predictable DNA off-target effects of cytosine base editor by using dual guiders including sgRNA and TALE”的研究論文,成功構建了新型安全高效的單堿基基因編輯系統。
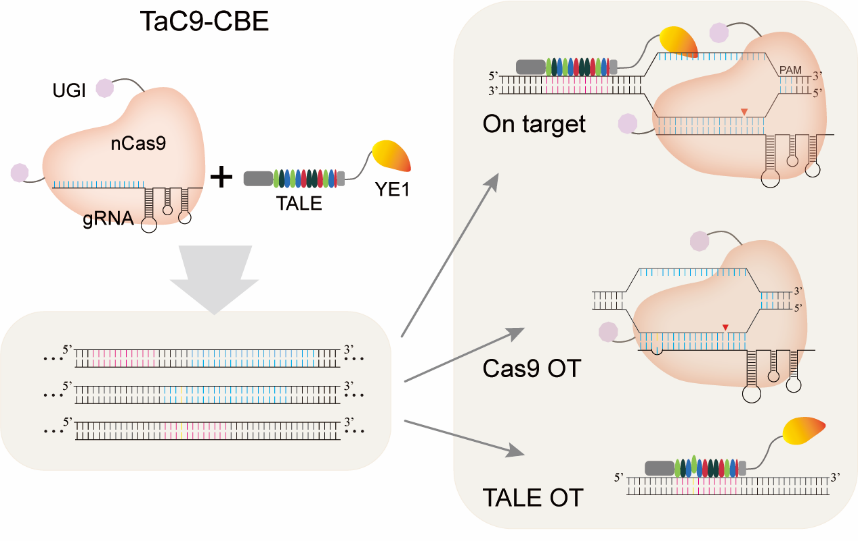
該論文首次將胞苷脫氨酶與轉錄激活因子樣效應子(TALE)融合,并結合gRNA/nCas9,開發了一種名為TaC9-CBE的新型堿基編輯系統。該系統僅在TALE和Cas9共同靶位點進行高效編輯,而在脫靶位點沒有編輯作用。gRNA/nCas9復合物在gRNA引導下結合到目標DNA位點,打開雙鏈并切割靶向DNA單鏈。同時,TALE-腺苷脫氨酶融合蛋白也結合到靶位點,脫氨酶對單鏈DNA進行編輯,實現靶位點的C到T突變。而在脫靶位點,由于gRNA/nCas9復合物不形成DSB,也沒有脫氨酶組分,不會進行基因編輯;同理,TALE-胞苷脫氨酶融合蛋白由于無法形成ssDNA,脫氨酶也不能行使堿基編輯作用。研究結果證實,TaC9-ABE堿基編輯系統在保證高效單堿基編輯的同時,對gRNA依賴的脫靶位點以及TALE依賴的脫靶位點進行深度測序均未檢測到脫靶現象。該研究為基因編輯動植物的培育和人類遺傳性疾病的基因治療提供了一個安全的單堿基編輯工具。
張焜教授博士生周繼曾、賴良學研究員博士生劉洋、碩士生魏愈惠和鄭淑文為論文共同第一作者。
另外,該團隊于2022年3月利用相同原理開發了一種不產生Cas9依賴性脫靶的新型腺嘌呤堿基編輯系統TaC9-ABE。相關成果以Elimination of Cas9-dependent off-targeting of adenine base editor by using TALE to separately guide deaminase to the target site為題在線發表在Cell Discovery雜志上。該研究再次證實了此基因編輯系統的廣泛應用價值。
廣東省醫學大動物模型重點實驗室由五邑大學和中國科學院廣州生物醫藥與健康研究院共同建設,于2021年3月正式獲批成立。近三年,五邑大學籌集資金近4億元,建設國際一流醫學大動物模型研究基地;吸引了包括韓國科學院院士在內的大動物模型研究專家和國內外優秀青年博士。近一年時間,在大動物模型、基因編輯和肝臟人源化等領域取得了重要突破,相關論文發表于MolecularTherapy,CellDiscovery,AdvancedScience以及Hepatology等國際高水平學術期刊上。(文/圖 生物科技與大健康學院)